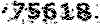کلاس شیمی نمونه دولتی خوارزمی
این وبلاگ به مطالب مطرح شده در کلاسهای درس شیمی دبیرستان نمونه دولتی خوارزمی درگهان می پردازد . احمد رحیمی هلریکلاس شیمی نمونه دولتی خوارزمی
این وبلاگ به مطالب مطرح شده در کلاسهای درس شیمی دبیرستان نمونه دولتی خوارزمی درگهان می پردازد . احمد رحیمی هلریسلول سوختی
لطفا درباره شکل 10 بخش 4 شیمی پیش دانشگاهی توضیح دهید.
این سلولها معمولا بر حسب نوع الکترولیت مورد استفاده دسته بندی می شوند.
شکل 10 – صفحه 99 کتاب شیمی پیش دانشگاهی سلول سوختی قلیایی (AFC) Alkaline fuel cells را نشان می دهد
در این سلول از گرافیت متخلخل در آند و کاتد استفاده شده است زیرا این ماده ی رسانای جریان برق با مواد موجود ،واکنش نمی دهد و همچنین متخلخل بودن آن باعث افزایش سطح تماس می شود ، الکترولیت بکار رفته هم یک قلیا می باشد ( محلول پتاسیم هیدروکسید KOH ).
نیم واکنش کاهش در کاتد : O2(g) + 2H2O(l) + 4e- à 4OH-(aq)
نیم واکنش اکسایش در آند: 2H2(g) à 4H+(aq) + 4e-
یون هیدروکسید ( OH- ) به سمت آند حرکت کرده و با H+ ترکیب شده آب تولید می کند
4H+(aq) + 4OH-(aq) à 4H2O(l)
در نتیجه می توانیم نیم واکنش اکسایش در آند را بصورت زیر نیز بنویسیم
2H2(g) + 4OH-(aq) à 4H2O(l) +4e-
اگر با استفاده از جدول 2 صفحه 94 ولتاژ این سلول را محاسبه کنیم در حالت اول عدد 23/1 ولت و برای حالت دوم 4/0 ولت بدست می آید اما ولتاژ واقعی هر سلول سوختی قلیایی حدود 8/0 (میانگین دو عدد فوق ) است.
برای اینکه ولتاژ بیشتری ایجاد شود چند سلول سوختی را بصورت سری به هم متصل می کنند.
در این سلول گرمای حاصل از واکنش باعث می شود دما تا حدود 80 درجه سانتیگراد افزایش یابد و مقداری آب بصورت بخار ، همراه گاز هیدروژن و اکسیژن اضافی خارج شود.
نقش الکترولیت : انتقال ذرات دارای بار الکتریکی از یک الکترود به الکترود دیگر